Las bacterias de los hongos proporcionan pistas sobre los orígenes de la vida compleja
Los científicos implantan bacterias en hongos para descifrar los orígenes de la vida compleja y crear nuevas simbiosis.
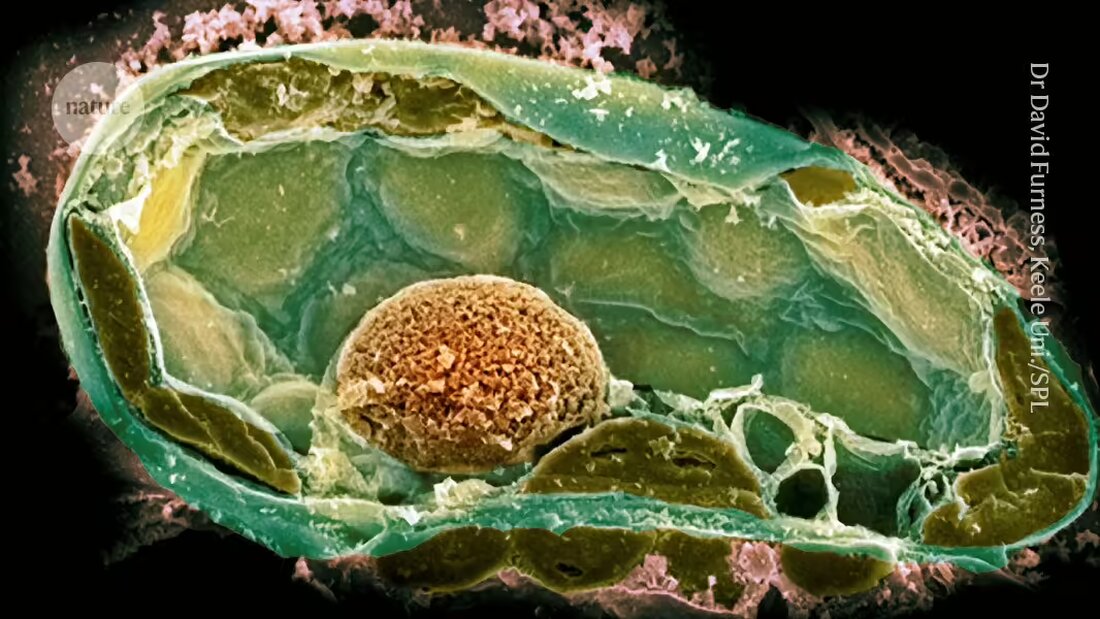
Las bacterias de los hongos proporcionan pistas sobre los orígenes de la vida compleja
Los científicos, utilizando una pequeña aguja hueca y una bomba de bicicleta, lograron implantar bacterias en una célula más grande. Esto crea una relación similar a las que impulsaron la evolución de la vida compleja.
Este logro, publicado el 2 de octubre en la revista Nature 1, podría ayudar a los investigadores a comprender los orígenes de las asociaciones que condujeron a la aparición de orgánulos especializados como las mitocondrias y los cloroplastos hace más de mil millones de años.
Las relaciones endosimbióticas, en las que una microbacteriana vive armoniosamente dentro de las células de otro organismo, se encuentran en numerosas formas de vida, incluidos insectos y hongos. Los científicos creen que las mitocondrias, los orgánulos responsables de la producción de energía en las células, surgieron cuando una bacteria encontró refugio en un antepasado de las células eucariotas. Los cloroplastos surgieron cuando un ancestro de las plantas absorbió un microorganismo fotosintético.
Determinar los factores que formaron y mantuvieron estas conexiones es difícil porque ocurrieron hace mucho tiempo. Para solucionar este problema, un equipo dirigido por la microbióloga Julia Vorholt del Instituto Federal Suizo de Tecnología de Zurich (ETH Zurich) ha desarrollado en los últimos años relaciones endosimbióticas en el laboratorio. Su enfoque utiliza una aguja de 500-1000 nanómetros de ancho para perforar las células huésped y luego introducir células bacterianas una a la vez.
Sin embargo, los primeros intentos fracasaron a menudo; Una de las razones de esto fue que el posible simbionte se dividió demasiado rápido y mató a su anfitrión. 2. El equipo tuvo más éxito cuando recrearon una simbiosis natural entre algunas cepas del hongo patógeno vegetal Rhizopus microsporus y la bacteria Mycetohabitans rhizoxinica, que produce una toxina que protege al hongo de la depredación.
Sin embargo, introducir células bacterianas en los hongos fue un desafío porque tienen paredes celulares gruesas que mantienen una alta presión interna. Después de perforar la pared con la aguja, los investigadores utilizaron una bomba de bicicleta (más tarde un compresor) para mantener suficiente presión para introducir las bacterias.
Después del shock inicial de la “cirugía”, los hongos continuaron su ciclo de vida, produciendo esporas, algunas de las cuales contenían bacterias. Cuando estas esporas germinaron, las bacterias también estaban presentes en las células de la siguiente generación de hongos. Esto demostró que la nueva endosimbiosis podría transmitirse a la descendencia, un hallazgo crucial.
Sin embargo, el éxito de la germinación de las esporas que contienen bacterias fue bajo. En una población mixta de esporas (algunas con bacterias y otras sin ellas), las que contenían bacterias desaparecieron después de dos generaciones. Para mejorar las relaciones, los investigadores utilizaron un clasificador de células fluorescentes para seleccionar esporas que contenían bacterias (que habían sido marcadas con una proteína brillante) y propagaron sólo esas esporas en futuras rondas de reproducción. Después de diez generaciones, las esporas que contenían bacterias germinaron casi tan eficientemente como las que no tenían bacterias.
La base de este ajuste no está clara. La secuenciación del genoma identificó algunas mutaciones asociadas con un mayor éxito de germinación en el hongo (una cepa de R. microsporus que no porta endosimbiontes) y no encontró cambios en las bacterias.
La línea que germinó con mayor eficiencia pareció limitar la cantidad de bacterias en cada espora, dice Gabriel Giger, coautor del estudio y microbiólogo de ETH Zurich. "Hay maneras en que estos dos socios pueden vivir juntos mejor y más fácilmente. Esto es algo que es muy importante que entendamos".
Los investigadores aún no saben mucho sobre el sistema inmunológico de los hongos. Pero Thomas Richards, biólogo evolutivo de la Universidad de Oxford, Reino Unido, se pregunta si un sistema inmunológico fúngico previene la simbiosis y si las mutaciones en este sistema podrían facilitar las relaciones. "Soy un gran admirador de este trabajo", añade.
Eva Nowack, microbióloga de la Universidad Heinrich Heine de Düsseldorf, Alemania, se sorprendió de la rapidez con la que parecían surgir adaptaciones a la vida simbiótica. En el futuro, le gustaría ver qué sucede después de períodos de tiempo aún más largos; por ejemplo, después de más de 1.000 generaciones.
El desarrollo de tales simbiosis podría conducir a la creación de nuevos organismos con propiedades útiles, como la capacidad de consumir dióxido de carbono o nitrógeno atmosférico, afirma Vorholt. “Ésa es la idea: crear nuevas propiedades que un organismo no tiene y que de otro modo serían difíciles de implementar”.
-
Giger, G.H. et al. Naturaleza https://doi.org/10.1038/s41586-024-08010-x (2024).
-
Gäbelein, C. G., Reiter, M. A., Ernst, C., Giger, G. H. y Vorholt, J. A. ACS Synth. Biol. 11, 3388–3396 (2022).

 Suche
Suche
 Mein Konto
Mein Konto
