Les bactéries présentes dans les champignons fournissent des indices sur les origines d’une vie complexe
Les scientifiques implantent des bactéries dans des champignons pour décrypter les origines d’une vie complexe et créer de nouvelles symbioses.
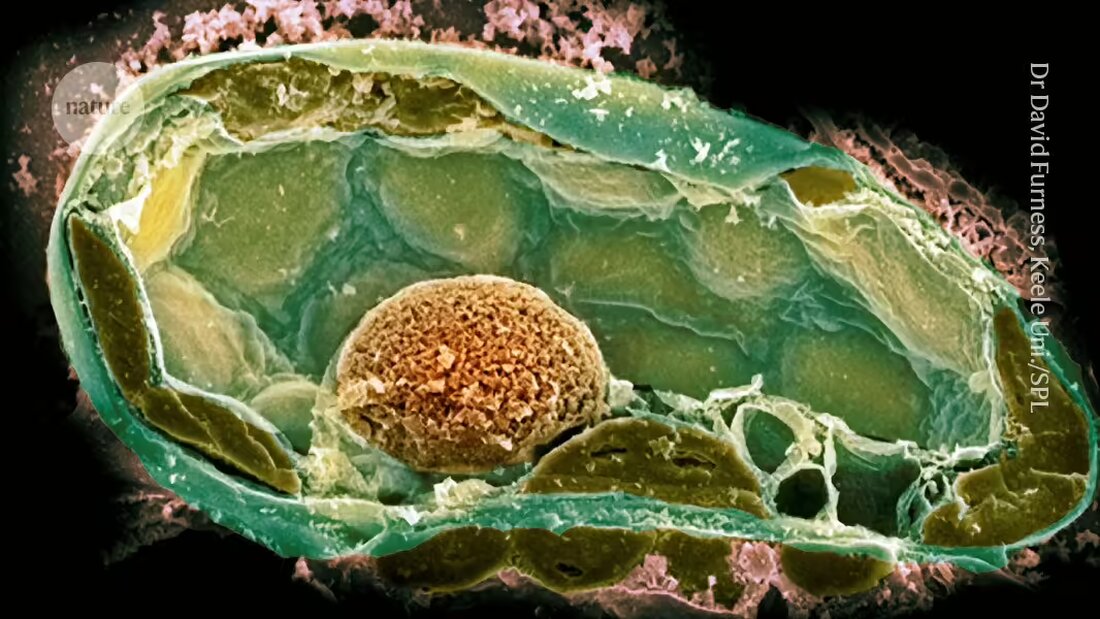
Les bactéries présentes dans les champignons fournissent des indices sur les origines d’une vie complexe
Les scientifiques utilisant une petite aiguille creuse et une pompe à vélo ont réussi à implanter des bactéries dans une cellule plus grande. Cela crée une relation similaire à celles qui ont conduit à l’évolution de la vie complexe.
Cette réalisation, publiée le 2 octobre dans la revue Nature 1, pourrait aider les chercheurs à comprendre les origines des partenariats qui ont conduit à l’émergence d’organites spécialisés tels que les mitochondries et les chloroplastes il y a plus d’un milliard d’années.
Les relations endosymbiotiques, dans lesquelles un partenaire microbactérien vit harmonieusement au sein des cellules d'un autre organisme, se retrouvent dans de nombreuses formes de vie, notamment les insectes et les champignons. Les scientifiques pensent que les mitochondries – les organites responsables de la production d’énergie dans les cellules – sont apparues lorsqu’une bactérie a trouvé refuge chez un ancêtre des cellules eucaryotes. Les chloroplastes sont apparus lorsqu'un ancêtre des plantes a absorbé un micro-organisme photosynthétique.
Il est difficile de déterminer les facteurs qui ont formé et entretenu ces liens, car ils se sont produits il y a très longtemps. Pour contourner ce problème, une équipe dirigée par la microbiologiste Julia Vorholt de l'École polytechnique fédérale de Zurich (ETH Zurich) a développé ces dernières années des relations endosymbiotiques en laboratoire. Leur approche utilise une aiguille de 500 à 1 000 nanomètres de large pour percer les cellules hôtes, puis introduire les cellules bactériennes une par une.
Cependant, les premières tentatives échouèrent souvent ; une des raisons à cela était que le symbiote potentiel se divisait trop rapidement et tuait son hôte. 2. L’équipe a eu plus de succès lorsqu’elle a recréé une symbiose naturelle entre certaines souches du phytopathogène fongique Rhizopus microsporus et la bactérie Mycetohabitans rhizoxinica, qui produit une toxine qui protège le champignon de la prédation.
Cependant, l’introduction de cellules bactériennes dans les champignons était difficile car elles possèdent des parois cellulaires épaisses qui maintiennent une pression interne élevée. Après avoir percé la paroi avec l’aiguille, les chercheurs ont utilisé une pompe à vélo – plus tard un compresseur – pour maintenir une pression suffisante pour introduire la bactérie.
Après le choc initial de la « chirurgie », les champignons ont continué leur cycle de vie, produisant des spores, dont certaines contenaient des bactéries. Lorsque ces spores germaient, des bactéries étaient également présentes dans les cellules de la génération suivante de champignons. Cela a montré que la nouvelle endosymbiose pouvait être transférée à la progéniture – une découverte cruciale.
Cependant, le succès de germination des spores contenant des bactéries était faible. Dans une population mixte de spores (certaines avec des bactéries et d'autres sans), celles contenant des bactéries disparaissaient après deux générations. Pour améliorer les relations, les chercheurs ont utilisé un trieur de cellules fluorescentes pour sélectionner les spores contenant des bactéries – qui avaient été marquées avec une protéine lumineuse – et ont propagé uniquement ces spores lors des futurs cycles de reproduction. Après dix générations, les spores contenant des bactéries ont germé presque aussi efficacement que celles sans bactéries.
La base de cet ajustement n’est pas claire. Le séquençage du génome a identifié certaines mutations associées à un meilleur succès de germination chez le champignon - une souche de R. microsporus qui n'est pas connue pour porter des endosymbiontes - et n'a trouvé aucun changement dans la bactérie.
La lignée qui a germé le plus efficacement semble limiter le nombre de bactéries dans chaque spore, explique Gabriel Giger, co-auteur de l'étude et microbiologiste à l'ETH Zurich. "Il existe des moyens permettant à ces deux partenaires de vivre ensemble mieux et plus facilement. C'est quelque chose qu'il est très important pour nous de comprendre."
Les chercheurs ne savent pas encore grand-chose sur le système immunitaire des champignons. Mais Thomas Richards, biologiste évolutionniste à l'Université d'Oxford, au Royaume-Uni, se demande si un système immunitaire fongique empêche la symbiose – et si des mutations dans ce système pourraient faciliter ces relations. « Je suis un grand fan de ce travail », ajoute-t-il.
Eva Nowack, microbiologiste à l'Université Heinrich Heine de Düsseldorf, en Allemagne, a été surprise de la rapidité avec laquelle les adaptations à la vie symbiotique semblent émerger. À l’avenir, elle aimerait voir ce qui se passe après des périodes encore plus longues ; par exemple, après plus de 1 000 générations.
Le développement de telles symbioses pourrait conduire à la création de nouveaux organismes dotés de propriétés utiles, telles que la capacité de consommer du dioxyde de carbone ou de l'azote atmosphérique, explique Vorholt. « C’est là l’idée : créer de nouvelles propriétés qu’un organisme ne possède pas et qui autrement seraient difficiles à mettre en œuvre. »
-
Giger, G.H. et coll. Nature https://doi.org/10.1038/s41586-024-08010-x (2024).
-
Gäbelein, C.G., Reiter, M.A., Ernst, C., Giger, GH et Vorholt, J.A. ACS Synth. Biol. 11, 3388-3396 (2022).

 Suche
Suche
 Mein Konto
Mein Konto
