I batteri nei funghi forniscono indizi sulle origini della vita complessa
Gli scienziati impiantano batteri nei funghi per decifrare le origini della vita complessa e creare nuove simbiosi.
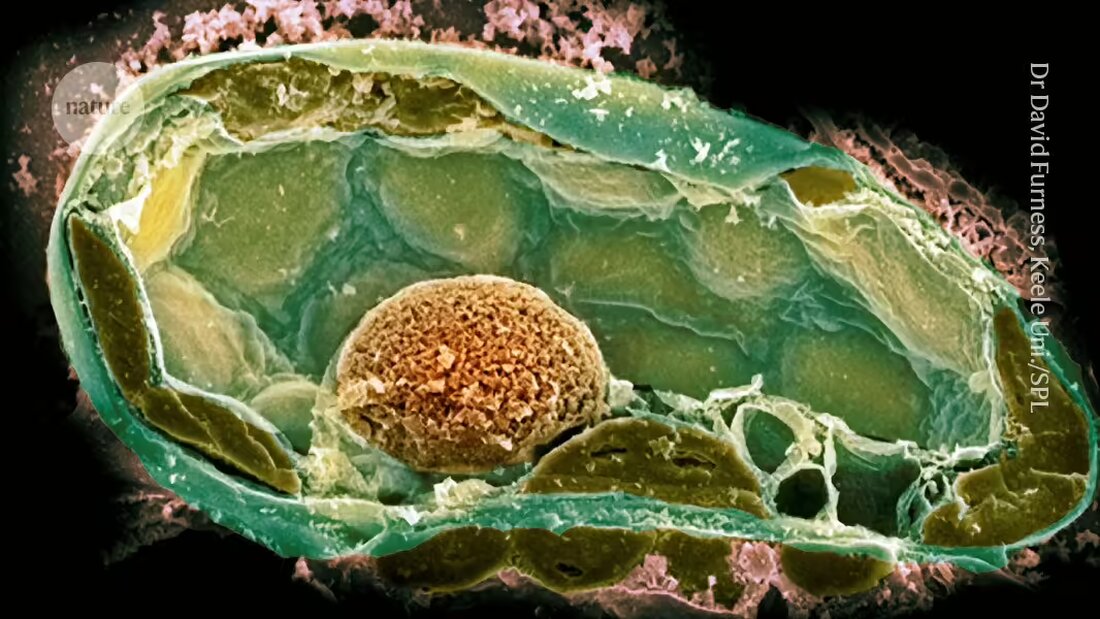
I batteri nei funghi forniscono indizi sulle origini della vita complessa
Utilizzando un minuscolo ago cavo e una pompa da bicicletta, gli scienziati sono riusciti a impiantare batteri in una cellula più grande. Ciò crea una relazione simile a quelle che hanno guidato l’evoluzione della vita complessa.
Questo risultato, pubblicato il 2 ottobre sulla rivista Nature 1, potrebbe aiutare i ricercatori a comprendere le origini delle collaborazioni che hanno portato alla nascita di organelli specializzati come i mitocondri e i cloroplasti più di un miliardo di anni fa.
Le relazioni endosimbiotiche, in cui un partner microbatterico vive armoniosamente all'interno delle cellule di un altro organismo, si trovano in numerose forme di vita, inclusi insetti e funghi. Gli scienziati ritengono che i mitocondri, gli organelli responsabili della produzione di energia nelle cellule, siano nati quando un batterio ha trovato rifugio in un antenato delle cellule eucariotiche. I cloroplasti emersero quando un antenato delle piante assorbì un microrganismo fotosintetico.
Determinare i fattori che hanno formato e mantenuto queste connessioni è difficile perché si sono verificati molto tempo fa. Per aggirare questo problema, un team guidato dalla microbiologa Julia Vorholt del Politecnico federale di Zurigo (ETH Zurigo) ha sviluppato negli ultimi anni relazioni endosimbiotiche in laboratorio. Il loro approccio utilizza un ago largo 500-1000 nanometri per perforare le cellule ospiti e quindi introdurre le cellule batteriche una alla volta.
Tuttavia i primi tentativi spesso fallivano; una delle ragioni di ciò era che il potenziale simbionte si divise troppo rapidamente e uccise il suo ospite 2. Il team ha avuto più successo quando ha ricreato una simbiosi naturale tra alcuni ceppi del patogeno fungino Rhizopus microsporus e il batterio Mycetohabitans rhizoxinica, che produce una tossina che protegge il fungo dalla predazione.
Tuttavia, l’introduzione di cellule batteriche nei funghi è stata impegnativa perché hanno pareti cellulari spesse che mantengono un’elevata pressione interna. Dopo aver perforato la parete con l’ago, i ricercatori hanno utilizzato una pompa da bicicletta – in seguito un compressore – per mantenere una pressione sufficiente per introdurre i batteri.
Dopo lo shock iniziale dell’“intervento chirurgico”, i funghi hanno continuato il loro ciclo vitale, producendo spore, alcune delle quali contenevano batteri. Quando queste spore germinavano, i batteri erano presenti anche nelle cellule della successiva generazione di funghi. Ciò ha dimostrato che la nuova endosimbiosi potrebbe essere trasferita alla prole: una scoperta cruciale.
Tuttavia, il successo della germinazione delle spore contenenti batteri era basso. In una popolazione mista di spore (alcune con batteri e altre senza), quelle contenenti batteri scomparivano dopo due generazioni. Per migliorare i rapporti, i ricercatori hanno utilizzato un selezionatore di cellule fluorescenti per selezionare spore contenenti batteri – che erano stati contrassegnati con una proteina luminosa – e hanno propagato solo quelle spore nei futuri cicli di riproduzione. Dopo dieci generazioni, le spore contenenti batteri germinavano con la stessa efficienza di quelle prive di batteri.
La base di questo aggiustamento non è chiara. Il sequenziamento del genoma ha identificato alcune mutazioni associate a un migliore successo della germinazione nel fungo – un ceppo di R. microsporus non noto per trasportare endosimbionti – e non ha trovato cambiamenti nei batteri.
La linea che germinava in modo più efficiente sembrava limitare il numero di batteri in ciascuna spora, afferma Gabriel Giger, coautore dello studio e microbiologo dell'ETH di Zurigo. "Ci sono modi in cui questi due partner possono vivere insieme meglio e più facilmente. Questo è qualcosa che è molto importante per noi capire."
I ricercatori non sanno ancora molto sul sistema immunitario dei funghi. Ma Thomas Richards, biologo evoluzionista dell'Università di Oxford, nel Regno Unito, si chiede se un sistema immunitario fungino impedisca la simbiosi e se le mutazioni in questo sistema potrebbero facilitare le relazioni. “Sono un grande fan di questo lavoro”, aggiunge.
Eva Nowack, microbiologa dell'Università Heinrich Heine di Düsseldorf, in Germania, è rimasta sorpresa dalla rapidità con cui sembravano emergere gli adattamenti alla vita simbiotica. In futuro vorrebbe vedere cosa succede dopo periodi di tempo ancora più lunghi; ad esempio, dopo più di 1.000 generazioni.
Lo sviluppo di tali simbiosi potrebbe portare alla creazione di nuovi organismi con proprietà utili, come la capacità di consumare anidride carbonica o azoto atmosferico, afferma Vorholt. “L’idea è questa: creare nuove proprietà che un organismo non possiede e che altrimenti sarebbero difficili da implementare”.
-
Giger, G.H. et al. Natura https://doi.org/10.1038/s41586-024-08010-x (2024).
-
Gäbelein, C. G., Reiter, M. A., Ernst, C., Giger, G. H. & Vorholt, J. A. ACS Synth. Biol. 11, 3388–3396 (2022).

 Suche
Suche
 Mein Konto
Mein Konto
