Bacteriën in schimmels geven aanwijzingen over de oorsprong van complex leven
Wetenschappers implanteren bacteriën in schimmels om de oorsprong van complex leven te ontcijferen en nieuwe symbiose te creëren.
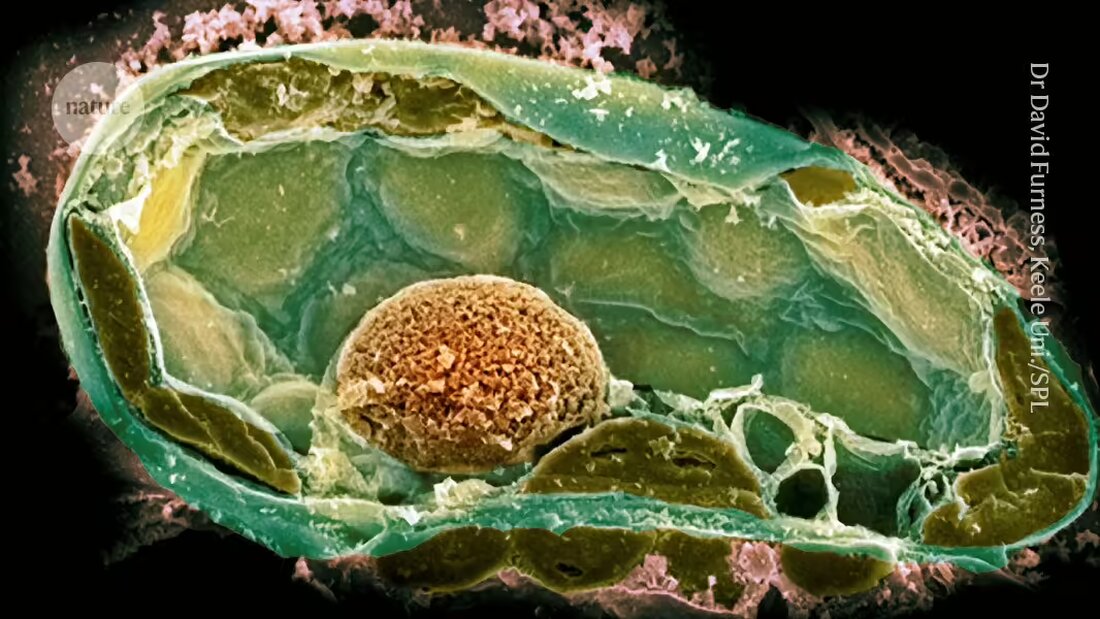
Bacteriën in schimmels geven aanwijzingen over de oorsprong van complex leven
Wetenschappers zijn er met behulp van een kleine holle naald en een fietspomp in geslaagd bacteriën in een grotere cel te implanteren. Dit creëert een relatie die vergelijkbaar is met de relaties die de evolutie van het complexe leven aandreven.
Deze prestatie, gepubliceerd op 2 oktober in het tijdschrift Nature 1, zou onderzoekers kunnen helpen de oorsprong te begrijpen van partnerschappen die meer dan een miljard jaar geleden hebben geleid tot de opkomst van gespecialiseerde organellen zoals mitochondriën en chloroplasten.
Endosymbiotische relaties, waarbij een microbacteriële partner harmonieus leeft in de cellen van een ander organisme, worden aangetroffen in talloze levensvormen, waaronder insecten en schimmels. Wetenschappers geloven dat mitochondria – de organellen die verantwoordelijk zijn voor de energieproductie in cellen – ontstonden toen een bacterie een toevluchtsoord vond in een voorouder van eukaryote cellen. Chloroplasten ontstonden toen een voorouder van planten een fotosynthetisch micro-organisme absorbeerde.
Het bepalen van de factoren die deze verbindingen vormden en in stand hielden, is moeilijk omdat ze zo lang geleden plaatsvonden. Om dit probleem te omzeilen heeft een team onder leiding van microbioloog Julia Vorholt van het Zwitserse Federale Instituut voor Technologie in Zürich (ETH Zürich) de afgelopen jaren endosymbiotische relaties in het laboratorium ontwikkeld. Hun aanpak maakt gebruik van een 500-1000 nanometer brede naald om gastheercellen te doorboren en vervolgens bacteriële cellen één voor één te introduceren.
De eerste pogingen mislukten echter vaak; een reden hiervoor was dat de potentiële symbiont zich te snel verdeelde en zijn gastheer doodde 2. Het team had meer succes toen ze een natuurlijke symbiose creëerden tussen sommige stammen van de schimmelplantenziekteverwekker Rhizopus microsporus en de bacterie Mycetohabitans rhizoxinica, die een toxine produceert dat de schimmel beschermt tegen predatie.
Het introduceren van bacteriële cellen in de schimmels was echter een uitdaging omdat ze dikke celwanden hebben die een hoge interne druk handhaven. Nadat ze de muur met de naald hadden doorboord, gebruikten de onderzoekers een fietspomp – later een compressor – om voldoende druk te behouden om de bacteriën te introduceren.
Na de eerste schok van de ‘operatie’ zetten de schimmels hun levenscyclus voort en produceerden sporen, waarvan sommige bacteriën bevatten. Toen deze sporen ontkiemden, waren er ook bacteriën aanwezig in de cellen van de volgende generatie schimmels. Hieruit bleek dat de nieuwe endosymbiose kon worden overgedragen op het nageslacht – een cruciale bevinding.
Het kiemsucces van de bacteriehoudende sporen was echter laag. In een gemengde populatie van sporen (sommige met bacteriën en sommige zonder) verdwenen de sporen die bacteriën bevatten na twee generaties. Om de relaties te verbeteren, gebruikten de onderzoekers een fluorescerende celsorteerder om sporen te selecteren die bacteriën bevatten - die waren getagd met een gloeiend eiwit - en alleen die sporen voort te planten in toekomstige reproductierondes. Na tien generaties ontkiemden de sporen met bacteriën bijna net zo efficiënt als die zonder bacteriën.
De basis voor deze aanpassing is niet duidelijk. Genoomsequencing identificeerde enkele mutaties die verband hielden met een verbeterd kiemsucces bij de schimmel - een stam van R. microsporus waarvan niet bekend is dat deze endosymbionten draagt - en vond geen veranderingen in de bacterie.
De lijn die het meest efficiënt ontkiemde, leek het aantal bacteriën in elke spore te beperken, zegt Gabriel Giger, co-auteur van het onderzoek en microbioloog aan de ETH Zürich. "Er zijn manieren waarop deze twee partners beter en gemakkelijker kunnen samenleven. Dat is iets dat voor ons heel belangrijk is om te begrijpen."
Onderzoekers weten nog niet veel over het immuunsysteem van schimmels. Maar Thomas Richards, een evolutiebioloog aan de Universiteit van Oxford, VK, vraagt zich af of een schimmelimmuunsysteem symbiose voorkomt - en of mutaties in dit systeem de relaties zouden kunnen vergemakkelijken. “Ik ben een grote fan van dit werk”, voegt hij eraan toe.
Eva Nowack, microbioloog aan de Heinrich Heine Universiteit Düsseldorf, Duitsland, was verbaasd over hoe snel aanpassingen aan het symbiotische leven leken te ontstaan. In de toekomst zou ze graag zien wat er na nog langere tijd gebeurt; bijvoorbeeld na meer dan 1.000 generaties.
De ontwikkeling van dergelijke symbiose zou kunnen leiden tot de creatie van nieuwe organismen met nuttige eigenschappen, zoals het vermogen om kooldioxide of atmosferische stikstof te consumeren, zegt Vorholt. “Dat is het idee: nieuwe eigenschappen creëren die een organisme niet heeft en die anders moeilijk te implementeren zouden zijn.”
-
Giger, G.H. et al. Natuur https://doi.org/10.1038/s41586-024-08010-x (2024).
-
Gäbelein, C.G., Reiter, M.A., Ernst, C., Giger, G.H. & Vorholt, J.A. ACS Synth. Biol. 11, 3388–3396 (2022).

 Suche
Suche
 Mein Konto
Mein Konto
