Bactérias em fungos fornecem pistas sobre as origens da vida complexa
Os cientistas implantam bactérias em fungos para decifrar as origens da vida complexa e criar novas simbioses.
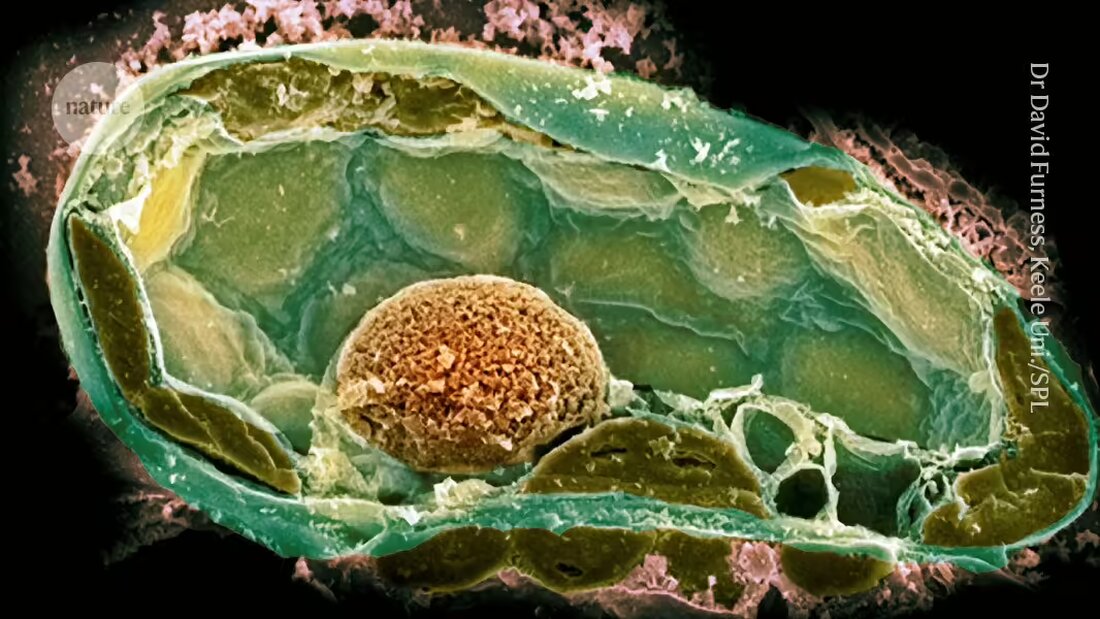
Bactérias em fungos fornecem pistas sobre as origens da vida complexa
Cientistas, usando uma pequena agulha oca e uma bomba de bicicleta, conseguiram implantar bactérias em uma célula maior. Isto cria uma relação semelhante àquelas que impulsionaram a evolução da vida complexa.
Esta conquista, publicada em 2 de outubro na revista Nature 1, poderia ajudar os investigadores a compreender as origens das parcerias que levaram ao surgimento de organelas especializadas, como mitocôndrias e cloroplastos, há mais de mil milhões de anos.
As relações endossimbióticas, nas quais um parceiro microbacteriano vive harmoniosamente dentro das células de outro organismo, são encontradas em inúmeras formas de vida, incluindo insetos e fungos. Os cientistas acreditam que as mitocôndrias – organelas responsáveis pela produção de energia nas células – surgiram quando uma bactéria encontrou refúgio em um ancestral das células eucarióticas. Os cloroplastos surgiram quando um ancestral das plantas absorveu um microrganismo fotossintético.
Determinar os factores que formaram e mantiveram estas ligações é difícil porque ocorreram há muito tempo. Para contornar este problema, uma equipe liderada pela microbiologista Julia Vorholt, do Instituto Federal Suíço de Tecnologia de Zurique (ETH Zurique), desenvolveu relações endossimbióticas em laboratório nos últimos anos. A abordagem deles usa uma agulha de 500-1000 nanômetros de largura para perfurar as células hospedeiras e depois introduzir as células bacterianas, uma de cada vez.
Contudo, as primeiras tentativas falharam frequentemente; uma razão para isso foi que o simbionte potencial se dividiu muito rapidamente e matou seu hospedeiro 2. A equipe teve mais sucesso ao recriar uma simbiose natural entre algumas cepas do fungo patógeno vegetal Rhizopus microsporus e a bactéria Mycetohabitans rhizoxinica, que produz uma toxina que protege o fungo da predação.
No entanto, a introdução de células bacterianas nos fungos foi um desafio porque possuem paredes celulares espessas que mantêm alta pressão interna. Depois de perfurar a parede com a agulha, os pesquisadores usaram uma bomba de bicicleta – mais tarde um compressor – para manter pressão suficiente para introduzir a bactéria.
Após o choque inicial da “cirurgia”, os fungos continuaram o seu ciclo de vida, produzindo esporos, alguns dos quais continham bactérias. Quando esses esporos germinaram, as bactérias também estavam presentes nas células da próxima geração de fungos. Isto mostrou que a nova endossimbiose poderia ser transferida para a prole – uma descoberta crucial.
No entanto, o sucesso da germinação dos esporos contendo bactérias foi baixo. Numa população mista de esporos (alguns com bactérias e outros sem), aqueles que continham bactérias desapareceram após duas gerações. Para melhorar as relações, os investigadores usaram um classificador de células fluorescentes para selecionar esporos contendo bactérias - que tinham sido marcadas com uma proteína brilhante - e propagaram apenas esses esporos em futuras rondas de reprodução. Após dez gerações, os esporos contendo bactérias germinaram de forma quase tão eficiente quanto aqueles sem bactérias.
A base para este ajustamento não é clara. O sequenciamento do genoma identificou algumas mutações associadas a um melhor sucesso na germinação do fungo - uma cepa de R. microsporus que não é conhecida por transportar endossimbiontes - e não encontrou alterações nas bactérias.
A linhagem que germinou de forma mais eficiente pareceu limitar o número de bactérias em cada esporo, diz Gabriel Giger, coautor do estudo e microbiologista da ETH Zurique. "Existem formas pelas quais estes dois parceiros podem viver juntos melhor e mais facilmente. Isso é algo que é muito importante compreendermos."
Os pesquisadores ainda não sabem muito sobre o sistema imunológico dos fungos. Mas Thomas Richards, biólogo evolucionista da Universidade de Oxford, no Reino Unido, questiona-se se um sistema imunitário fúngico impede a simbiose - e se as mutações neste sistema poderiam facilitar as relações. “Sou um grande fã deste trabalho”, acrescenta.
Eva Nowack, microbiologista da Universidade Heinrich Heine em Düsseldorf, Alemanha, ficou surpresa com a rapidez com que as adaptações à vida simbiótica pareciam emergir. No futuro, ela gostaria de ver o que acontece depois de períodos de tempo ainda mais longos; por exemplo, depois de mais de 1.000 gerações.
O desenvolvimento de tais simbioses poderia levar à criação de novos organismos com propriedades úteis, como a capacidade de consumir dióxido de carbono ou nitrogênio atmosférico, diz Vorholt. “Essa é a ideia: criar novas propriedades que um organismo não possui e que de outra forma seriam difíceis de implementar.”
-
Giger, G.H. e outros. Natureza https://doi.org/10.1038/s41586-024-08010-x (2024).
-
Gäbelein, CG, Reiter, MA, Ernst, C., Giger, GH e Vorholt, JA ACS Synth. Biol. 11, 3388–3396 (2022).

 Suche
Suche
 Mein Konto
Mein Konto
