Première mondiale : une thérapie avec des cellules de donneurs conduit à la rémission de maladies auto-immunes
Une nouvelle thérapie utilisant des cellules immunitaires dérivées de donneurs et modifiées par CRISPR réduit les maladies auto-immunes chez trois patients en Chine.
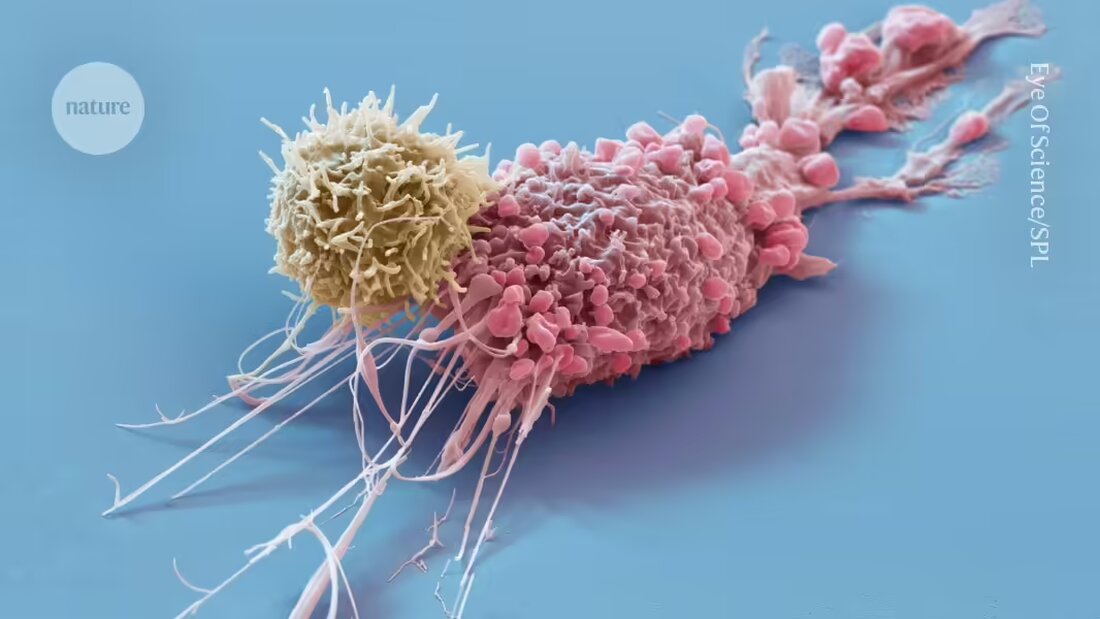
Première mondiale : une thérapie avec des cellules de donneurs conduit à la rémission de maladies auto-immunes
Une femme et deux hommes atteints de maladies auto-immunes graves ont connu une rémission après un traitement avec des cellules immunitaires issues de la bio-ingénierie et modifiées par CRISPR 1. Ces trois personnes originaires de Chine sont les premières personnes atteintes de maladies auto-immunes à être traitées avec des cellules immunitaires fabriquées à partir de cellules de donneurs, plutôt que de recevoir ces cellules de leur propre corps. Cette avancée constitue la première étape vers la production massive de telles thérapies.
Un receveur, M. Gong, un homme de Shanghai de 57 ans atteint de sclérose systémique, qui affecte le tissu conjonctif et peut provoquer un raidissement de la peau et des lésions des organes, a rapporté que trois jours après le traitement, il avait remarqué un relâchement de sa peau et qu'il était capable de recommencer à bouger ses doigts et à ouvrir à nouveau la bouche. Il est retourné au travail deux semaines plus tard. «Je me sens très bien», dit-il plus d'un an après le traitement.
Des cellules immunitaires modifiées, connues sous le nom de cellules T du récepteur d'antigène chimérique (CAR), ont été utilisées dans le traitement des cancers du sang. grand espoir montré - une poignée de produits se trouvent aux États-Unis approuvé - et il existe un potentiel dans le traitement des maladies auto-immunes telles que Lupus et Sclérose en plaques, dans lequel des cellules immunitaires aberrantes produisent des auto-anticorps qui attaquent les propres tissus de l'organisme. Cependant, la thérapie repose généralement sur les propres cellules immunitaires de la personne, ce qui la rend coûteuse et longue.
C’est pourquoi les chercheurs ont commencé à développer des thérapies CAR T à partir de cellules immunitaires données. En cas de succès, les sociétés pharmaceutiques pourraient augmenter leur production, ce qui augmenterait probablement la Coût et les temps de production peuvent être considérablement réduits. Au lieu de réaliser un seul traitement pour une personne, des thérapies pour plus d'une centaine de personnes pourraient être réalisées à partir des cellules d'un seul donneur, a déclaré Lin Xin, immunologiste à l'Université Tsinghua de Pékin. Les cellules CAR T provenant de cellules de donneurs ont déjà été utilisées pour traiter des patients atteints de cancer, mais jusqu'à présent avec un succès limité 2.
Maladies auto-immunes
L'étude, dirigée par Xu Huji, rhumatologue à l'Université de médecine navale de Shanghai, est la première à rapporter des résultats sur les maladies auto-immunes. Ceux-ci ont été publiés le mois dernier dans la revue Cell. Les receveurs sont restés en rémission plus de six mois après le traitement. Selon Xu, deux douzaines de personnes supplémentaires ont désormais reçu le traitement par cellules de donneur et un produit légèrement modifié. Les résultats ont été pour la plupart positifs, dit-il.
« Les résultats cliniques sont phénoménaux », a déclaré Lin, qui dirige une étude distincte utilisant des cellules CAR T dérivées de donneurs pour traiter le lupus.
Le succès et la sécurité de cette thérapie semblent prometteurs, mais ils doivent être démontrés chez un plus grand nombre de personnes avant que les chercheurs puissent tirer des conclusions sur son utilisation généralisée, explique Christina Bergmann, rhumatologue à l'hôpital universitaire d'Erlangen en Allemagne.
Mais si l'essai réussit chez un plus grand nombre de personnes sur une période plus longue, cela pourrait "changer de paradigme", a déclaré Daniel Baker, immunologiste à l'Université de Pennsylvanie à Philadelphie. Plus de 80 maladies auto-immunes sont liées à des cellules immunitaires défectueuses.
Donneur en bonne santé
La thérapie par cellules CAR T consiste généralement à collecter des cellules immunitaires, appelées cellules T, auprès de la personne traitée. Ces cellules sont enrichies de protéines CAR qui attaquent les cellules B puis réinfusées dans le corps de la personne.
Le processus de production de cellules CAR T à partir de cellules immunitaires données est similaire. Xu et ses collègues ont prélevé des lymphocytes T sur une femme de 21 ans et les ont marqués avec des CAR qui reconnaissent le CD19, un récepteur présent à la surface des lymphocytes B. Ils ont utilisé l'outil de génie génétique CRISPR-Cas9 pour désactiver cinq gènes dans les cellules T, à la fois pour empêcher les cellules transplantées d'attaquer le corps de l'hôte et pour empêcher le système immunitaire de l'hôte d'attaquer les cellules du donneur.
La première personne à recevoir le traitement était une femme de 42 ans en mai 2023, atteinte d'un type de myopathie auto-immune qui attaque les tissus musculaires squelettiques, provoquant faiblesse et fatigue. M. Gong et un autre homme de 45 ans souffraient d'une forme agressive de sclérose. Ses traitements ont débuté en juin et août 2023.
Une fois injectées dans les hôtes, les cellules CAR T ont commencé à fonctionner. Ils ont multiplié et ciblé toutes les cellules B, y compris les cellules pathogènes liées aux maladies auto-immunes. Les cellules T issues de la bio-ingénierie ont survécu chez les receveurs pendant des semaines avant de disparaître pour la plupart. Finalement, de nouvelles cellules B saines sont revenues alors qu’il ne restait plus de cellules pathogènes. Une réaction similaire a été observée chez les personnes atteintes Maladies auto-immunes observés qui ont reçu des cellules CAR T dérivées de leurs propres cellules 3.
« Rémission complète »
Deux mois après le traitement, les chercheurs rapportent que la femme a atteint une rémission complète et a conservé ce statut lors de son suivi de six mois. Baker note que même si la femme a montré une amélioration clinique significative, il serait plus prudent avant de qualifier cela de rémission complète car le délai d'évaluation était court. Les auto-anticorps de la femme étaient tombés à des niveaux indétectables, et sa force musculaire et sa mobilité s'étaient considérablement améliorées.
Les deux hommes ont également constaté des améliorations significatives de leurs symptômes – notamment la régression du tissu cicatriciel – ainsi qu’une diminution des taux d’auto-anticorps.
Aucune des personnes n’a présenté de réaction inflammatoire extrême connue sous le nom de syndrome de libération de cytokines, qui a été observée chez certains patients cancéreux recevant un traitement CAR-T, et n’a montré aucune preuve que la greffe avait attaqué l’hôte. Cependant, les chercheurs tentent toujours de déterminer si l’hôte rejette la greffe au fil du temps.
Un problème de sécurité majeur identifié chez certaines personnes recevant des thérapies cellulaires CAR-T pour traiter le cancer est le suivant Apparition de nouvelles tumeurs, bien que les chercheurs continuent d’étudier s’ils sont liés à la thérapie. Baker souligne qu’il est trop tôt pour savoir si les personnes atteintes de maladies auto-immunes traitées avec des cellules CAR T dérivées d’un donneur courent ce risque. "Seul le temps nous le dira."
La question clé désormais, selon Baker, est de savoir si la même approche fonctionnera pour un plus grand nombre de personnes et quelle sera la durée des effets. « Ces patients resteront-ils sans symptômes pendant des années ?
-
Wang, X. et coll. Cellule 187, 4890-4904 (2024).
-
Chiesa, R. et al. N Engl J Med 389, 899-910 (2023).
-
Müller, F. et al. N Engl J Med 390, 687-700 (2024).

 Suche
Suche
 Mein Konto
Mein Konto
