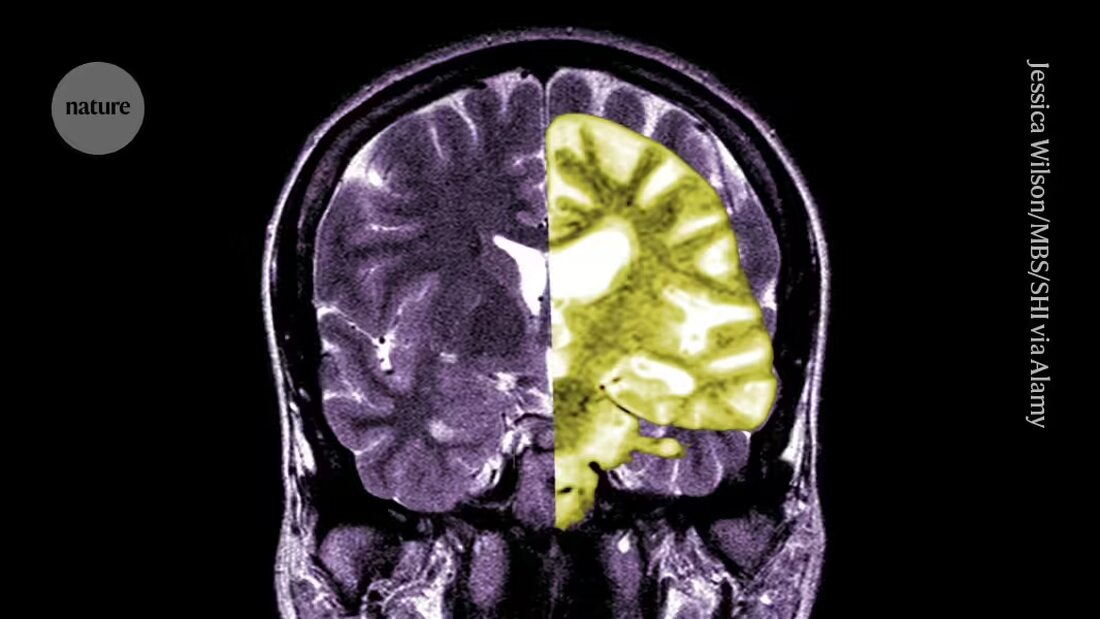
Debatte über das Alzheimer-Medikament Lecanemab – eines der ersten Medikamente, das den kognitiven Abbau bei Menschen verlangsamt – intensiviert sich unter Forschern und Klinikern darüber, ob die potenziellen Vorteile der Behandlung die Risiken überwiegen.
Am 22. August gab die britische Arzneimittelbehörde Medicines and Healthcare Products Regulatory Agency grünes Licht für das Medikament. Gleichzeitig sagte jedoch der britische Gesundheitsregulator NICE, der bestimmt, ob Medikamente Patienten im staatlich finanzierten britischen Gesundheitsdienst (NHS) angeboten werden, in einem Entwurf, dass Lecanemab nicht auf dem NHS zur Verfügung gestellt wird, da die Vorteile zu gering sind, um die hohen Kosten zu rechtfertigen.
„Die ungewöhnlich lange Zeit, die sie mit der Prüfung des Arzneimittels verbracht haben, legt nahe, dass dies keine leichte oder einfache Entscheidung war“, sagte der Psychiater Robert Howard von der Universität College London in einer Erklärung an das Science Media Centre in Großbritannien.
US-Regulierungsbehörden waren die ersten, die das Medikament 2023 zugelassen haben, und die Europäische Arzneimittelagentur (EMA) überprüft nun ihre Entscheidung nach einer Berufung des Arzneimittelherstellers.
Amyloid-Ziel
Die Entscheidung der EMA stieß auch bei der Alzheimer-Gemeinschaft auf gemischte Reaktionen. „Die Emotionen sind hier wirklich hoch“, sagt der Biochemiker Christian Haass von der Ludwig-Maximilians-Universität in München, Deutschland, der mit der Entscheidung nicht einverstanden ist. „Es ist das erste krankheitsmodifizierende Medikament, das wir seit mehr als 30 Jahren haben.“ Die Verweigerung von Patienten, auf Lecanemab zuzugreifen, bedeutet laut Haass, dass viele die Möglichkeit verlieren, wertvolle Zeit zu gewinnen.
Lecanemab oder Leqembi ist ein monoklonaler Antikörper, der Amyloid, eine Substanz, die sich in den Gehirnen von Menschen mit Alzheimer zu toxischen Klumpen zusammenballt, beseitigt. Das Medikament, hergestellt von Eisai in Tokio und Biogen in Cambridge, Massachusetts, ist auch in China, Japan, Südkorea und den Vereinigten Arabischen Emiraten zugelassen.
Andere begrüßen die EMA und sagen, dass das Medikament zwar effektiv die Amyloidwerte im Gehirn gesenkt hat, ob die daraus resultierende Reduktion des kognitiven Abbaus zu klinisch relevanten Vorteilen für die Patienten führen wird, bleibt unklar. Sie geben an, dass die Möglichkeit schwerwiegender Komplikationen wie Blutungen oder Schwellungen im Gehirn, verursacht durch eine Nebenwirkung namens amyloidbezogene Bildgebungseffekte (ARIA), obwohl gering, eine große Sorge darstellt. „Eine vernünftige Bewertung der Risiken im Vergleich zu den Vorteilen dieses Medikaments sollte die Menschen dazu bringen, sehr skeptisch zu sein“, sagt Matthew Schrag, Neurologe an der Vanderbilt University in Nashville, Tennessee.
Bescheidene Effekte
Ob Lecanemab, das durch Infusion verabreicht wird, den Menschen eine klinisch sinnvolle Reduzierung des kognitiven Abbaus bietet, wurde lange diskutiert.
Eine klinische Phase-III-Studie des Medikaments, die 2022 veröffentlicht wurde, umfasste 1.795 Personen in den frühen Stadien der Alzheimer-Krankheit und ergab, dass diejenigen, die das Medikament erhielten, nach 18 Monaten eine 27% ige Reduktion des kognitiven Abbaus im Vergleich zu denen zeigten, die ein Placebo erhielten. Einige Forscher feierten die Nachricht als einen Sieg für das Feld. Andere argumentierten jedoch, dass die Effekte zu gering sind, um eine bedeutende Wirkung auf die Patienten zu haben.
Einer der Gründe für diesen Unterschied in der Perspektive liegt darin, wie Menschen die Daten betrachten, sagt Sebastian Walsh, ein Public-Health-Forscher an der Universität Cambridge, Großbritannien. Die 27% ige Reduktion repräsentiert den relativen Unterschied in der Menge des kognitiven Abbaus, den die Gruppe mit dem Medikament im Vergleich zur Placebogruppe erfahren hat. Der absolute Unterschied in der kognitiven Funktion ist jedoch viel geringer: 0,45 Punkte auf einer 18-Punkte-Skala. „Menschen können aus der Effektgröße das extrahieren, was sie wollen“, sagt Walsh. „Wenn sie das Medikament verkaufen wollen, könnten sie sich auf relative Veränderungen konzentrieren – und wenn sie sehr skeptisch sind, könnten sie über die absoluten Unterschiede sprechen.“
Aber selbst kleine Effekte können im Laufe der Zeit bedeutsam werden, insbesondere in den späteren Stadien der Krankheit, wenn der Abbau schneller voranschreitet, sagt Walsh. „Letztendlich hängt es davon ab, was Sie denken, welche langfristige Wirkung eintreten wird, und darauf haben wir keine Antwort.“
Nun liegen einige Langzeitdaten vor. Auf der Alzheimer Association International Conference (AAIC) in Philadelphia letzten Monat präsentierten Eisai und Biogen Ergebnisse aus einer offenen Verlängerungsstudie, die die Patienten, die Lecanemab nach Abschluss der Phase-III-Studie erhalten hatten, weiterhin überwachte. Nach drei Jahren kontinuierlicher Behandlung zeigte mehr als die Hälfte der Patienten eine Verbesserung, und die meisten Fälle von ARIA traten in den ersten sechs Monaten der Behandlung auf. Sie berichteten auch, dass die Rate des kognitiven Abbaus wieder auf Placebo-Niveau zurückkehrte, wenn die Menschen das Medikament absetzten, auch wenn die Amyloid-Plaques entfernt worden waren, bevor die Behandlung beendet wurde.
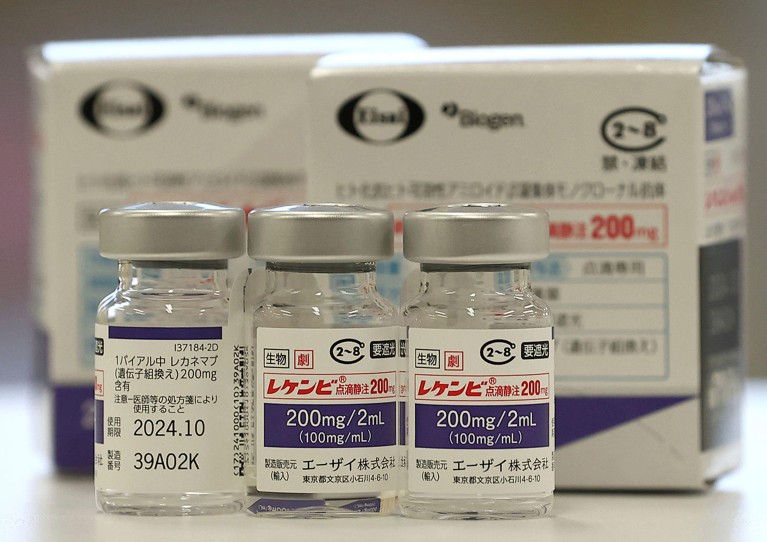
Einige sind optimistisch über diese Ergebnisse – Haass sagt, dass es spannend ist zu sehen, dass das Medikament nicht nur Amyloid beseitigt, sondern auch die Ausbreitung von Tau verlangsamt, einem weiteren Protein, das sich in den Gehirnen von Menschen mit Alzheimer zu Klumpen ansammelt. Andere sind vorsichtiger. Paresh Malhotra, Neurologe am Imperial College London, weist darauf hin, dass die positiven Ergebnisse, die auf der AAIC vorgestellt wurden, nicht mit einem Placebo verglichen wurden, sodass mehr Daten erforderlich sind, um die langfristige Wirksamkeit des Medikaments zu bestimmen.
Auch die Kosten sind ein Anliegen. Walsh sagt, dass es angesichts der bescheidenen Effekte des Arzneimittels schwierig ist, die Kosten für die Verabreichung des Medikaments (das in den USA mehr als 20.000 US-Dollar pro Jahr kostet) und die erforderlichen Verfahren wie Bildgebung und genetische Tests zu rechtfertigen, um berechtigte Personen zu identifizieren, die es erhalten sollen.
Sicherheitsbedenken
Die größte Sorge bei Lecanemab ist ARIA, vor der die US-amerikanische Lebensmittel- und Arzneimittelbehörde (FDA) in ihrer Zulassung gewarnt hat. Obwohl die meisten Fälle asymptomatisch sind – und während der anfänglichen 18-monatigen klinischen Studie keine berichtet wurden -, gab es einige ARIA-bedingte Todesfälle in der verlängerten Phase der Studie.
Einige Experten sagen, dass obwohl das Risiko schwerer ARIA gering ist, es auch wichtig ist zu berücksichtigen, dass das Medikament in den frühesten Stadien von Alzheimer verabreicht wird. „Dies ist der Zeitraum, in dem die Menschen am meisten zu verlieren haben“, sagt Schrag. „Wir ermutigen die Patienten in diesem Zeitfenster oft dazu, zu reisen, über ihre Wunschliste nachzudenken und die Dinge zu erledigen, die sie im Leben erreichen wollen.“
Ellis van Etten, Neurologe am Leiden University Medical Center in den Niederlanden, sagt, dass es immer noch viele offene Fragen zu ARIA gibt und wie Ärzte reagieren sollten, wenn sie sehen, dass Patienten während der Behandlung diese Abnormalitäten entwickeln. Zum Beispiel: Wer wird schwerwiegende oder lebensbedrohliche ARIA entwickeln? Ab wann wird ARIA von harmlos zu schädlich, und wann sollte die Behandlung mit Lecanemab abgebrochen werden?
Viele der gleichen Fragen zu Nutzen und Risiken gelten auch für einen weiteren amyloidbeseitigenden Antikörper, Donanemab – hergestellt von Eli Lilly in Indianapolis, Indiana -, der im Juli von der FDA zugelassen wurde. Donanemab scheint eine ungefähr gleich große Reduktion des kognitiven Abbaus wie Lecanamab zu bieten – und er wurde mit ARIA-bedingten Todesfällen in Verbindung gebracht.
„Wir wissen aus biomarkerbezogener Arbeit, dass diese Antikörper Amyloid beseitigen, daher wissen wir, dass sie einen grundlegenden Mechanismus der Krankheit ansprechen“, sagt Malhotra. Aber diese Medikamente allein werden wahrscheinlich nicht ausreichen, und es wird wichtig sein, sich auch mit anderen Aspekten der Krankheit auseinanderzusetzen. „Es ist sehr wahrscheinlich, dass wir in zehn Jahren über Kombinationstherapien sprechen werden und dass die Amyloidbeseitigung Teil dieses Ansatzes sein wird.“

 Suche
Suche
 Mein Konto
Mein Konto